(1)スピンドル形成と微小管アンカーリング
真核細胞においてスピンドル(紡錘体)は複製された染色体を娘細胞に均等に分配するために必須な役割を果たしています。スピンドルは細胞分裂の際に微小管によって形成される双極性の構造体で細胞分裂装置とも呼ばれています(図1A)。微小管の伸長は、γ-チューブリン複合体(γ-TuC)が重合核となり、α-およびβ-チューブリンから成るヘテロ二量体が順次、方向性を持って繊維状に重合することにより起こります。チューブリンヘテロ二量体が付加しやすい微小管側はプラス端、解離しやすい側はマイナス端と呼ばれます(図1B)。分裂期の細胞ではスピンドル微小管のマイナス端は二つのスピンドル極体に集合し、プラス端は細胞中央部で染色体と直接結合するか、あるいはプラス端同士が重なりあった逆平行構造を取ることが知られています。この双極性の構築と維持には一群の微小管結合分子が関与していることが近年明らかになってきています。しかし、双極性が構築・維持される間、どのようにしてスピンドルのマイナス端がスピンドル極体につなぎ止められているのか(微小管アンカーリング)、その分子機作・制御機構についてはほとんど判っていませんでした。
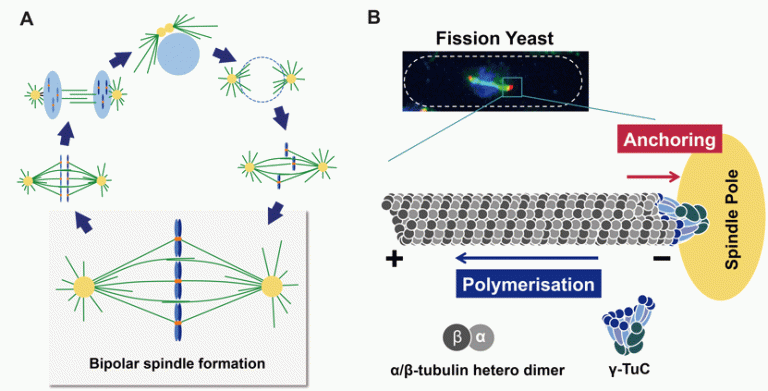
図1 スピンドル形成と微小管アンカーリング
A: 染色体の分配に必須な双極性スピンドルの形成
B: スピンドル微小管の重合とアンカーリング
(2)微小管アンカーリングに働くMsd1の発見
微小管アンカーリングにはスピンドル微小管の重合核として機能するγ-TuC が安定してスピンドル極体に局在し続ける必要があると考えられます。これまでにフランシス・クリック研究所の登田研究室では、真核モデル生物である分裂酵母を用いて、生育に必須、かつ進化上ヒトまで高度に保存された Mozart1/Mzt1がγ-TuCのスピンドル極体(分裂酵母ではSPB; Spindle Pole Body)へのリクルートに必要であること(Masuda et al., Mol. Biol. Cell, 2013)、新規タンパク質Msd1が微小管アンカーリングに必須な分子であることを発見しました。Msd1が欠損した酵母細胞はアンカーリング異常を引き起こし、スピンドル微小管のマイナス端がSPBの外側に異常に突出した表現型を示します。その結果、姉妹染色分体間のテンションをうまく維持できず、染色体の不分離を引き起こすことが判りました。また、Msd1はγ-TuCの構成因子であるAlp4/GCP2と相互作用し、この相互作用がアンカーリングに必須であることから、Msd1はAlp4を介してγ-TuCを含むマイナス端をSPBにつなぎとめている可能性が考えられました(図2: Toya et al., Nat. Cell Biol., 2007)。Msd1は進化上ヒトまで高度に保存されており、ヒトホモログSSX2IPも微小管アンカーリングに働くことが明らかにされています(Hori et al., EMBO Rep., 2014, Hori et al., Mol. Biol. Cell, 2015)。
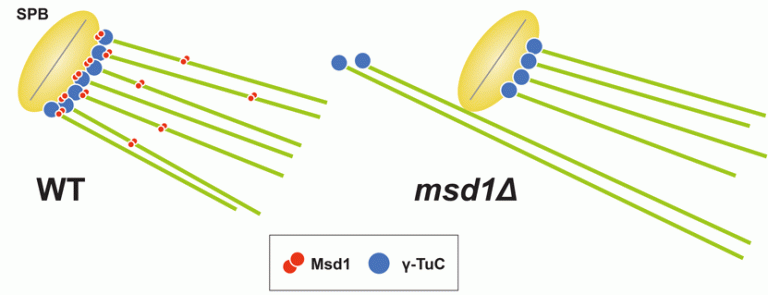
図2 Msd1とγ-TuCの相互作用を介した微小管アンカーリング
(3)微小管アンカーリングの分子機構
登田研究室では、Msd1以外にも新規因子Wdr8が微小管アンカーリングに働くことを発見しました。Wdr8はMsd1と複合体を形成してスピンドル極体に相互依存的に共局在します。最近、我々はMsd1-Wdr8複合体がマイナス端方向性キネシンであるPkl1/kinesin-14と相互作用して一緒に細胞核内に運ばれること(step1)、さらにMsd1-Wdr8複合体はPkl1によってスピンドル微小管を介してSPBに運ばれること(step2)、Pkl1はMsd1-Wdr8複合体によってSPBにアンカーされること(step3)を明らかにしました(図3)。Wdr8はMsd1とγ-TuCの結合を安定化させることにより微小管アンカーリングに寄与すると考えられます。
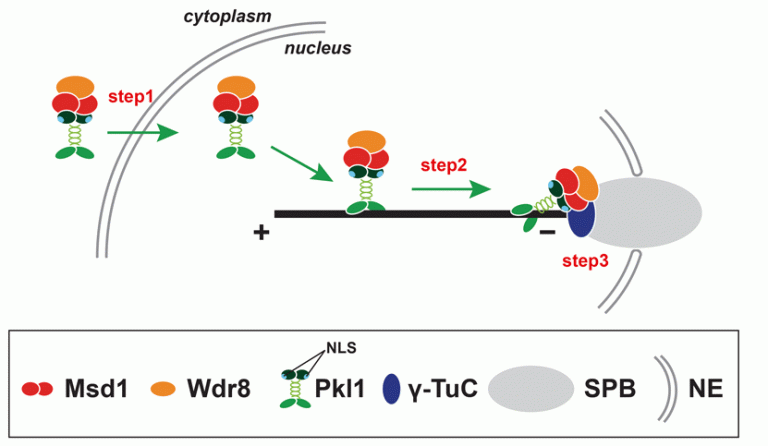
図3 Msd1-Wdr8-Pkl1複合体がSPBに局在するための分子機構モデル
また、大変興味深いことにmsd1欠損株が示すアンカーリング異常がプラス端方向性キネシンであるCut7/kinesin-5の機能欠損によって抑圧されることを見出しました。この結果は、kinesin-5が微小管上をプラス端に向かって移動する際に反作用で生じるスピンドル極体を押し離す力(Outward force)と、kinesin-14がマイナス端に向かって移動する際に生じる押し戻す力(Inward force)のバランスが極めて重要であること、kinesin-14が押し戻す力を生み出すためには微小管上を移動するだけでは不十分であり、Msd1-Wdr8複合体によってSPBに繋ぎ止められなければならないことを示唆しています(図4)。興味深いことに、モーター活性を持たない変異型Pkl1を強制的にSPBに局在させた場合、msd1欠損株が示すアンカーリング異常を部分的に抑圧したことから、kinesin-14はモーター活性に依存しないアンカーリング機能(Barrier)も有していると考えられます(図4: Yukawa et al., J. Cell Biol., 2015)。
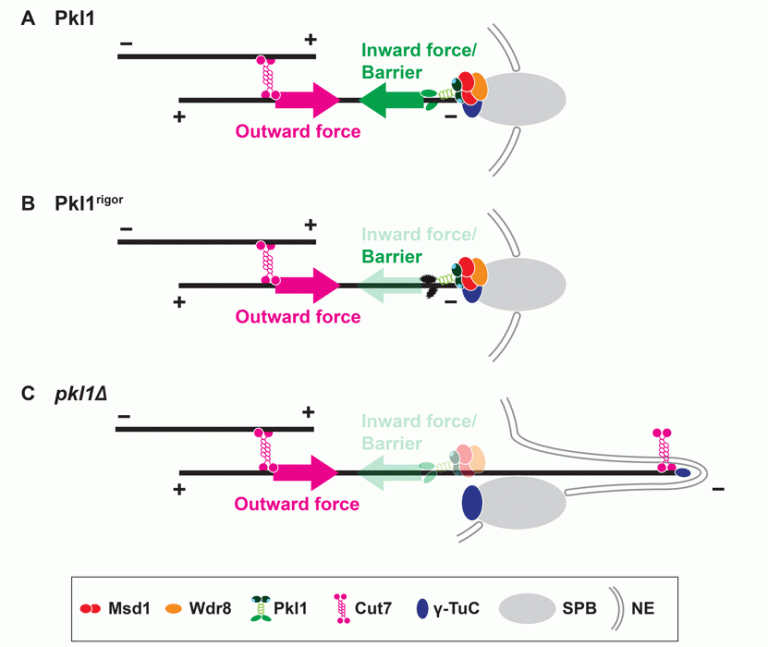
図4 Msd1-Wdr8-Pkl1複合体による微小管アンカーリングの分子機構モデル
A: 野生株の場合
B: モーター活性を持たないpkl1変異株の場合
C: pkl1欠損株の場合
